|
|
|
|
| 1章 水の構造と性質 | 小林 映章 |
|
1.1 水の構造
1.1.1 水分子の構造
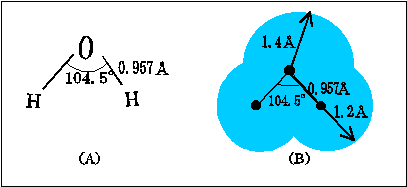
水分子H2Oは図1(A)のように酸素原子Oと2個の水素原子Hが共有結合で結ばれており、O—H 結合の距離は0.957Å、角度H—O—Hは104.5°です。これをさらに詳しくみると、図1(B)に示したような構造をしています。酸素原子を正四面体の中心に置いたとき、O—H 結合はこの酸素原子から正四面体のほぼ頂点方向に伸びています。中心と頂点の距離、すなわち、OとHの距離は0.957Åになります。また、2つのO—H 結合の作る角度は104.5°で幾何学的な正四面体の中心角109.5°と非常に近い値になっています。正四面体の残りの2つの頂点には酸素原子の2個の非共有電子対(孤立電子対:電子が2個ペアになって他の原子との結合性を失ったもの)が配向しています。
原子の大きさを表すのにファンデルワールス半径(van der Waals radius)というのがよく用いられます。分子性結晶を調べてみますと、構成単位である各分子の原子が一定半径の球のように充填しています。この球の半径をファンデルワールス半径といい、これは化学結合をしていないときの原子の大きさを表すものと考えることができます。酸素原子のファンデルワールス半径は1.4Å、水素原子のファンデスワールス半径は1.2Åであり、これを水分子に当てはめてみますと、水分子は図1(B)のように全体として球に近い形になります。
よく水は極性物質であるということが云われます。一般に原子が電子を引き付ける力は元素の種類によって異なっています。電子を引き付ける目安に電気陰性度があります。電気陰性が大きいほど電子を引き付ける力が大きいことになります。PaulingによるとOの電気陰性度は大きくて、フッ素Fに次いで大きな値を持っていますが、Hの電気陰性度は小さい値をもっています。このため、水分子のO─H結合は、完全に中性、すなわち完全な供有結合ではなく、電子がOの側に偏った Oδ-─Hδ+
の構造をしています。このために水は次節で述べるような水素結合を作りやすく、液体の状態でもクラスターを形成したり、多くの化合物と水素結合で結びつき、特異な性質を現すことになります。 |